Sommaire
ToggleLa transplantation pulmonaire a fait d’immenses progrès ces vingt, voire ces dix dernières années. Pourtant, aujourd’hui encore, trop peu de personnes souffrant de BPCO avec emphysème bénéficient d’une évaluation pré-greffe. L’accès de ces patients à l’offre de soins, répartie dans neuf centres sur le territoire, est un enjeu majeur. Les explications du Dr Antoine Roux, médecin transplanteur à l’Hôpital Foch (Suresnes, 92).
Quels sont les chiffres de la transplantation pulmonaire en France ?
Dr A. R : Il existe en France un réel défaut d’adressage des patients susceptibles de recevoir une transplantation pulmonaire. Deux explications à cela : un repérage insuffisant des patients BPCO qui pourraient en bénéficier et surtout une méconnaissance des centres experts où pourraient être envoyés les patients en vue d’une évaluation.
Environ 350 transplantations de poumons sont réalisées par an en France. Selon des projections un peu grossières, il faudrait sûrement en réaliser 600 de plus et atteindre le millier par an. La tendance est à l’augmentation du nombre de transplantations mais la part des personnes BPCO dans la totalité des transplantations pulmonaires n’est que de 30 % (soit 113 transplantations) en 2017. Les autres 70% sont constitués principalement de personnes souffrant de fibrose pulmonaire et de mucoviscidose.
Selon le registre international de la Société internationale de transplantation cardiaque et pulmonaire (ISHLT), le nombre de transplantations pulmonaires dans le monde augmente avec les années, progressivement, de 250 environ en 1990 à près de 4 000 aujourd’hui (1 000 concernant des personnes BPCO).
La proportion de transplantations pour BPCO avec emphysème a baissé entre la période 2004-2008 comparé à 2009-2017 au profit de la transplantation pour fibrose, mais surtout en Europe du Nord. En France, les indications de transplantation pour mucoviscidose couvrent l’essentiel des besoins annuels et sont beaucoup plus fréquentes qu’aux USA. En Europe, les différences de pratiques entre les pays sont minimes et les indications respectives de la greffe selon les différentes maladies pulmonaires restent stables dans le temps.
Sur quels éléments repose la décision du médecin transplanteur ?
La question à se poser est : « qu’attend-on de la transplantation ? » Un gain de survie bien entendu, mais aussi de qualité de vie, à soupeser avec la probabilité de survie sans transplantation. Or, la difficulté avec les patients BPCO, est que la survie à moyen terme sans transplantation explorée dans les études de score pronostique comme l’index de BODE est relativement correcte, alors qu’ils peuvent ressentir un handicap majeur avec une qualité de vie très dégradée.
Bien qu’étant dans un état très grave, après un épisode aigu, on peut espérer chez les patients BPCO une petite marge de récupération de la capacité respiratoire, et les ramener à leur niveau antérieur.
L’objectif de la transplantation est donc une combinaison entre la survie et la qualité de vie, à mettre en balance avec la situation sans transplantation. D’où la nécessité pour le transplanteur de recevoir la personne plusieurs fois afin de se rendre compte de sa situation respiratoire (pronostic estimé selon la stratification GOLD et l’indice BODE) et la manière dont il subit son handicap, avec l’éventualité d’améliorer sa qualité de vie à l’aide d’autres moyens que la transplantation (comme la réhabilitation respiratoire).
Le médecin transplanteur évalue ainsi les risques à ne pas transplanter et les risques à transplanter, en fonction des contre-indications éventuelles et l’accès au greffon (la durée d’attente du centre, le nombre de décès sur liste, la taille, et des paramètres immunologiques).
Quels sont les profils des patients BPCO greffés ?
Les critères théoriques d’indication à la transplantation pulmonaire, à relativiser selon le poids du handicap et l’espérance de vie notamment sont, pour les patients emphysémateux :
- Un score BODE ≥7 : il intègre l’indice de masse corporelle, le VEMS post-bronchodilatateur, le score de dyspnée et la distance parcourue, exprimée en mètres, lors d’une épreuve de marche de 6 minutes. L’index BODE apporte des informations supplémentaires autres que le VEMS, traduisant l’impact systémique de la maladie BPCO.
- Un volume expiratoire maximal par seconde (VEMS) <15 à 20%.
- Trois ou plus exacerbations aigües sévères/an.
- Une ou plus exacerbation aigüe hypercapnique (élévation trop importante du volume de CO2 au niveau sanguin).
- Une hypertension pulmonaire modérée à sévère.
L’un des critères suffit pour considérer une inscription sur liste et évidemment certains patients peuvent présenter plusieurs critères.
Peut-on être greffé des poumons à tout âge ?
Pendant longtemps, l’âge maximal de transplantation était 60 ans puis 62 ans. Désormais, à l’hôpital Foch et dans d’autres centres, une personne de 65 ans ou 70 ans peut être greffée, à condition de ne souffrir d’aucune maladie associée (comorbidité). Il n’y a pas de consensus sur l’âge maximum en France et les pratiques sont hétérogènes.
Il faut néanmoins être conscient que la mortalité péri-opératoire est considérablement plus élevée après 65 ans, d’où l’absence impérative de comorbidités.
Quelles sont les contre-indications à la transplantation pulmonaire ?
Les contre-indications dites absolues ou critères d’exclusion sont :
- La guérison d’un cancer datant de moins de 2 à 5 ans.
- Une dysfonction d’organe non traitable.
- Une pathologie psychiatrique non contrôlée.
- Des affections neuromusculaires dégénératives.
- Une non-adhérence répétée au traitement.
- Un environnement social insuffisant.
- Une hépatite B ou C active, une infection par le VIH (Sida) non contrôlée.
- Des déformations thoraco-rachidiennes.
- Un tabagisme, éthylisme et/ou toxicomanie de moins de six mois.
Attention, ces critères sont néanmoins à relativiser et il ne faut pas qu’il y ait d’autocensure par les pneumologues pour demander un avis à un médecin transplanteur pour leurs patients. Par exemple, un cancer de la prostate très localisé chez un homme de 60 ans, après discussion avec les oncologues/urologues n’est pas, en soi, une contre-indication.
Des contre-indications relatives, c’est-à-dire qui méritent discussion, sont un âge supérieur à 65 ans, une situation instable dont une ventilation mécanique invasive, une ECMO, une obésité (IMC > 30 kg/m2), une dénutrition, une incapacité fonctionnelle, une ostéoporose symptomatique, une colonisation à germes multirésistants, une chirurgie thoracique et une pleurodèse (acte médical consistant à empêcher la récidive d’un pneumothorax).
Les filtres pour envoyer le patient au médecin transplanteur en vue d’une évaluation pré-greffe doivent être relativement larges. En effet, le pneumologue ne doit pas hésiter à demander un avis d’expert pour ne pas priver un patient de la possibilité d’une greffe par l’application stricte de ces critères d’exclusion. De plus, au fur et à mesure des interactions avec le centre référent, les pneumologues vont pouvoir mieux comprendre les décisions finalement prises par les équipes de transplantation.
Quelles sont les différentes étapes en amont de la transplantation pulmonaire ?
Le patient ayant une insuffisance respiratoire chronique est évalué en premier lieu par un pneumologue ou son médecin traitant dans le cadre d’une évaluation non spécialisée, avec des filtres très larges. Il peut ensuite être adressé à un centre de référence pour une évaluation spécialisée, qui vérifiera les indications (la maladie est-elle suffisamment sévère pour justifier une évaluation pré-greffe ou une greffe ?), et les contre-indications absolues ou relatives éventuelles, ainsi qu’un bilan global du patient afin de repérer toutes les maladies associées et ainsi anticiper les complications et désamorcer les pièges en post-opératoire.
Parmi les examens demandés : une tomodensitométrie du thorax, une scintigraphie pulmonaire, une tomographie par émission de positons, une coronarographie, des examens vasculaires, des sérologies (HIV, hépatites, syphilis, virus d’Epstein-Barr, cytomégalovirus), un typage HLA et la recherche d’anticorps anti HLA, un bilan lipidique, une glycémie, une microbiologie des voies aériennes.
Qui sont les donneurs potentiels de poumons aujourd’hui ?
Contrairement aux donneurs de reins, il n’y a pas de donneurs de poumon vivants en France. Les donneurs sont en état de mort encéphalique. Récemment, la possibilité de prélèvement a été étendue aux donneurs en arrêt cardiaque irréversible (donneurs dits « Maastricht III », dans la majorité des cas à la suite d’une décision médicale d’arrêt de traitement). Cela permet en théorie d’obtenir 10 à 20% de greffons supplémentaires. Il y a eu moins de dix transplantation en 2017 issues de ces donneurs à cœur arrêté. Un peu plus en 2018.
Quel est le donneur idéal ?
Jusqu’en 2003, l’Agence de la biomédecine proposait pour des greffons de poumons essentiellement des donneurs dits « idéaux », c’est-à-dire âgés de moins de 55 ans, avec une capacité thoracique normale répondant à une série d’exigences : radiographie thoracique normale, PaO2/FiO2 >300 (comparaison entre le niveau d’oxygène présent dans le sang et la concentration d’oxygène dans l’air inspiré), une absence de tabagisme, absence de traumatisme, de néoplasie (prolifération cellulaire anormale/tumeur), de sécrétions purulentes. Or, ces greffons idéaux sont en effet relativement rares. D’où une situation de pénurie.
Depuis 2003, des greffons dits à « critères élargis » sont proposés beaucoup plus largement aux équipes de transplantation. Et il a été montré que le pronostic post-opératoire avec ces greffons était similaire aux greffons idéaux.
Cela a permis de gagner de nombreux greffons, lesquels peuvent être évalués avant transplantation selon une méthode ex vivo qui permet de lever tous les doutes sur la possibilité de la transplantation.
Greffe-t-on un seul ou les deux poumons à la fois ?
15 % sont des transplantations d’un unique poumon. Plus de 75% des transplantations pulmonaires sont des greffes bilatérales séquentielles au cours d’une même intervention (à différentier des transplantations « en bloc » avec la trachée, qui ont été abandonnées). 5 à 8% sont des transplantations cœur-poumons.
Les médecins explantent le premier poumon du receveur, placent le greffon en réalisant des anastomoses des vaisseaux (artères et veines) pulmonaires et des bronches, puis passent au second côté.
L’opération de double transplantation pulmonaire dure entre huit et dix heures en moyenne.
Accède-t-on facilement au greffon ?
Le nombre de transplantations pulmonaires en France est en légère progression. Il n’y a quasiment plus de « décès sur liste » (3% en France aujourd’hui), c’est-à-dire de personnes inscrites sur liste qui décèdent avant d’avoir pu être greffées.
En France, il y a 5,8 transplantations pulmonaires par million d’habitants (chiffres 2016). La moyenne des pays est de 6,4. Mais certains pays sont à 8,5 (Canada), 10,9 (Belgique) et même 12,8 (Autriche) ! D’autres sont plutôt à 3,3 (Finlande) ou 2,6 (Royaume-Uni). L’épidémiologie des maladies respiratoires ne peut expliquer de telles discordances. Tout est question de choix stratégiques de santé publique.
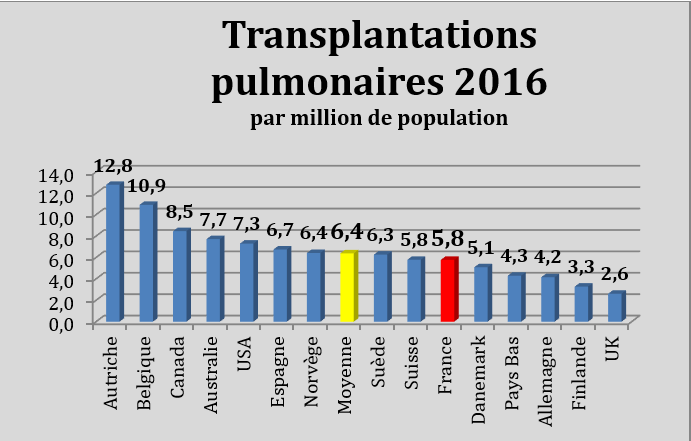
Certains pays prélèvent plus que d’autres : il est intéressant de comparer avec les chiffres des donneurs prélevés (d’au moins un organe), qui peuvent varier de 43 (par million d’habitants) en Espagne à 10,6 en Allemagne, en passant par 27,3 en France ; la moyenne étant de 26,1.
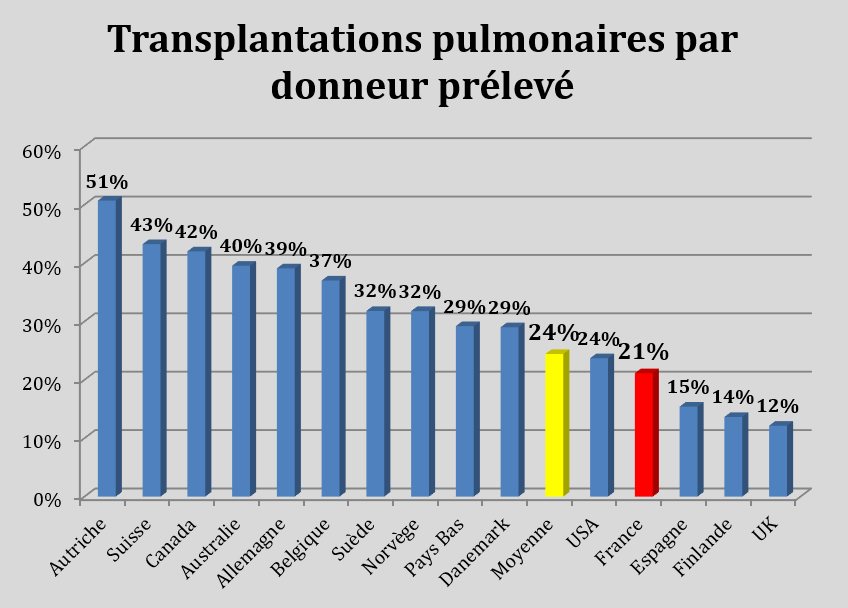
De plus, les transplantations pulmonaires par donneur prélevé peuvent être très améliorées. En France il n’y a que 21% de transplantation pulmonaire par donneur prélevé, contre 51% en Autriche. Cela signifie que la « ressource » de greffon pulmonaire en France est en partie améliorable.
Quelle est l’espérance de vie d’un greffon et d’une personne greffée ?
Avec les années, la survie après transplantation pulmonaire s’est nettement améliorée.
Lors des premières greffes dans les années 1960, les immunosuppresseurs n’existaient pas, d’où les échecs constants. Leur arrivée dans les années 1980 a relancé l’activité de greffe pulmonaire.
Les médianes de survie après greffe pulmonaire (valeur séparant la population en deux parties égales) peuvent atteindre aujourd’hui 8 à 10 ans.
Au niveau international, la survie globale est de 40% environ à 8 ans et 12% à 15 ans (pour la période 2011-2016).
Selon l’Agence de la biomédecine (France), la survie du receveur à 5 ans après une transplantation mono-pulmonaire est de 43% et après une transplantation bi-pulmonaire de 56%
Mais pour un potentiel candidat à la transplantation, il est plus parlant de parler de « scénarii » possibles, une approche plus concrète des préoccupations des personnes greffées. Le plus optimiste est une survie supérieure à 20 ans, avec reprise de l’ensemble des activités, des visites trimestrielles vécues comme des « formalités ».
A l’autre extrémité, on trouve le pire scénario avec le décès au bloc opératoire. Par ailleurs, il y a 5 à 10% de mortalité au cours de la première année, essentiellement déterminée par ce qui se passe lors de l’opération de transplantation et le post-opératoire précoce.
Entre ces deux extrémités, tous les cas intermédiaires existent, avec une hospitalisation prolongée de plusieurs mois ou des hospitalisations itératives pour complications successives.
Et il est impossible de prédire quel chemin empruntera un patient donné, sans aucune garantie.
Meilleure est la santé du patient avant la transplantation, plus ses chances de prendre le meilleur chemin sont importantes.
Les déterminants péjoratifs de la survie précoce sont une défaillance primaire de greffon (justifiant une assistance extracorporelle pour les échanges gazeux – ECMO), des complications mécaniques, une infection (bactérienne/fongique) ou un rejet. Ceci signifie que la transplantation est une situation où, naturellement, le patient va rejeter son greffon. Les médicaments immunosuppresseurs sont indispensables, car ils évitent le rejet du greffon qui est naturellement considéré comme « étranger » par l’organisme. Néanmoins, ils peuvent induire des effets secondaires, comme des infections plus fréquentes, la prolifération cellulaire au sens large (tumeurs) et les troubles métaboliques (hypertension, diabète, insuffisance rénale, etc.)
Que peut-on espérer d’une transplantation pulmonaire vis-à-vis de la capacité respiratoire ?
Supprimer le handicap !
L’important au cours de la phase de récupération qui peut durer plusieurs semaines ou mois, est la réhabilitation et la renutrition si besoin, jusqu’à une phase de plateau où la personne atteint sa cible de VEMS. Elle conservera ce niveau durant des années. Cependant, rien n’est garanti, avec de possibles complications au niveau des bronches ou un rejet dit « chronique » (après une période sans rejet), un facteur de très mauvais pronostic. Les progrès pour limiter ce rejet chronique sont considérables comparé à il y a 20 ans et même 10 ans. D’autres sont en cours, pour une médecine personnalisée et des traitements ciblés en fonction du type de rejet.
Pourquoi la transplantation pulmonaire est-elle certainement la plus délicate à réaliser ?
La réponse habituelle est que le poumon est un organe plus immunogène (déclenche plus de réponses allergiques), ouvert sur l’extérieur (risque d’inhalation d’agents infectieux, allergisants et irritants…). L’ischémie, c’est-à-dire la baisse d’oxygénation d’un organe par diminution ou privation d’apport sanguin artériel, est aussi plus importante que pour les autres organes.
Mais on peut maintenant se demander si cette affirmation reste vraie : les résultats se sont bien améliorés depuis 20 ans et la survie sans rejet, dans certains centres rejoint désormais celle des autres organes.
Quels sont les facteurs de réussite de cette chirurgie ?
Il vaut mieux adresser trop tôt que trop tard un patient pour un bilan pré-greffe, ce qui est encore malheureusement trop souvent le cas.
La sévérité de l’état respiratoire au moment de la greffe, un état de dénutrition (souvent le cas), des adhérences du revêtement des poumons ou plèvre (qui rend la chirurgie plus compliquée) et/ou une hypertension pulmonaire sont des facteurs péjoratifs.
Quelles sont les suites opératoires d’une transplantation du poumon ?
Ces chiffres valent pour le centre de transplantation de l’hôpital Foch (Suresnes).
38% des patients BPCO sortent extubés du bloc opératoire après une transplantation pulmonaire, une chirurgie pourtant très lourde. Ils sont d’ores et déjà en mesure de se passer d’une assistance respiratoire.
Pour les autres, la durée de ventilation est en moyenne de 4 jours (entre 1 et 13 jours). Le séjour en réanimation/soins intensifs est d’une dizaine de jours (entre 7 et 16) et le séjour hospitalier dure généralement 26 jours (entre 21 et 39 jours).
Mais il faut se préparer au scénario difficile car les suites post-opératoires peuvent s’avérer très compliquées avec des infections, des hémorragies, des neuromyopathies (anomalies neuromusculaires acquises en réanimation), une insuffisance rénale aigüe, et des complications spécifiques à la transplantation comme une défaillance primaire du greffon, un rejet aigu précoce ou une ischémie bronchique (insuffisance d’oxygénation du poumon).
Quelle est la réaction des personnes transplantées, en post-opératoire immédiat et sur la durée ?
Lorsque tout se passe bien, c’est une « renaissance ». Mais c’est aussi une remise en cause de leur état antérieur avec pour certaines personnes greffées quelque chose qui approche le syndrome de Lazare. Ce terme décrit les difficultés spécifiques auxquelles doivent faire face les sujets qui ont pu être confrontés à la certitude de leur propre mort, mais qui ont finalement survécu (comme le fait de se projeter de nouveau…).
Le suivi est régulier, dense et contraignant, y compris dans le meilleur des cas, avec des consultations (12 visites au cours de la première année, puis tous les trimestres et si besoin), des hospitalisations itératives, des fibroscopies bronchiques, des biopsies transbronchiques, des prises de sang, la mesure du souffle au domicile. Si l’état du patient est stable après 2-3 ans et sous certaines conditions, il peut être envisagé un suivi alterné avec d’autres équipes que celles du centre transplanteur, parfois géographiquement très éloignés du domicile du patient. C’est pourquoi le suivi alterné impliquant les centres de pneumologie référents et les médecins traitants est un enjeu majeur pour les années à venir.
Quelles sont les consignes à suivre en post-opératoire ?
Des mesures d’hygiène sont à respecter, comme s’abstenir de fumer, de boire de l’alcool (ou très peu), de bannir le pamplemousse pour éviter les interactions avec les médicaments. Les restrictions alimentaires sont débattues. La protection solaire est essentielle, du fait de la plus grande fréquence de cancers de la peau.
Une grossesse est possible, sous certaines conditions.
Les voyages en avion sont envisageables, à condition de conserver ses médicaments sur soi, de prévoir un rapatriement, de pouvoir rapidement faire une prise de sang ou se réapprovisionner en médicaments et, en cas de séjour prolongé, d’identifier l’hôpital le plus proche.
Quels sont les centres transplanteurs en France ?
- Hôpital Bichat (Paris, APHP)
- Hôpital Marie-Lannelongue (Le Plessis-Robinson)
- Hôpital Foch (Suresnes)
- CHU de Strasbourg, Lyon, Marseille, Toulouse, Bordeaux, Nantes
Quel est le risque de cancer du poumon sous immunosuppresseurs à vie ?
Il y a plusieurs niveaux de réponse :
Le risque de cancer en général est plus fréquent sous immunosuppresseurs que dans la population générale. En effet, le système immunitaire est chargé d’empêcher la formation de tumeurs. Or, les médicaments utiles pour éviter le rejet des organes greffés l’affaiblissent.
Dans notre cohorte de patients greffés du poumon, cela représente une fréquence de l’ordre de 7%, avec une bonne partie de cancers cutanés non graves. Le délai de survenue est en moyenne de 5 ans après la transplantation.
Quel que soit le risque relatif considéré – les variations sont importantes selon les publications scientifiques et le type de cancer – il s’agit d’un risque (probabilité de survenue de complications qui n’arrivera peut être jamais), alors qu’au moment de décider d’une transplantation, on est « certain » que le patient va décéder de sa maladie respiratoire.
Pour le cancer du poumon, deux circonstances sont à distinguer :
La transplantation d’un seul poumon : le poumon natif restant, notamment en cas de tabagisme antérieur, est à risque de développer un cancer (risque lié au tabac, souvent important, auquel s’ajoute celui dû à l’immunosuppression). C’est un argument pour préférer la transplantation bilatérale, lorsqu’elle est possible. Cette décision dépend du risque opératoire selon l’état général du patient, des comorbidités, de l’âge, des difficultés chirurgicales anticipées, etc.
La transplantation avec greffon de donneur tabagique : le risque de cancer est très faible (poumon avec pas /peu de tabac et imagerie réalisée pour vérifier l’absence d’image évocatrice au moment de l’identification du donneur), mais possible.
Plus d’informations sur le site de l’Agence de la biomédecine : https://www.agence-biomedecine.fr
Hélène Joubert (juin 2019).
Merci au Dr Antoine Roux et au Dr Marc Stern, pneumologues, Service de pneumologie et de transplantation pulmonaire, hôpital Foch, Suresnes.